S
Clinical Diagnostic Techniques
Home -> Diagnostik der Lyme-Borreliose - Eine Zusammenstellung
Diagnostik der Lyme-Borreliose
Eine Zusammenstellung von Aufsätzen von LL Bakken, PK Coyle und KB Liegner
übersetzt
und editiert [Zusätze] und Links von
Joachim Gruber
Inhalt
-
Coyle PK, Borrelia burgdorferi Infektion: Klinische Diagnostische Techniken
- Bakken LL, Callister SM, Wand PJ, Schell RF, Vergleich der Test-Resultate zur Feststellung von Lyme-Borreliose in 516 Laboratorien
- U. Everth U, Weller U, Waldherr A, Selected Aspects of Serology of Borrelia burgdorferi sensu lato
- Liegner KB, LYME BORRELIOSE: Die vernünftige Suche nach Antworten
- International Lyme and Associated Diseases Society, Positionspapier zur Diagnose von Lyme
- Honegr K et al., Criteria for evaluation of immunoblots using Borrelia afzelii, Borrelia garinii and Borrelia burgdorferi sensu stricto for diagnosis of Lyme borreliosis
Immunological Investigations 26(1&2):117-128 (1997)
Borrelia burgdorferi Infektion: Klinische Diagnostische Techniken
Borrelia burgdorferi infection: clinical diagnostic techniques
Department of Neurology, School of Medicine, State University of New York
at Stony Brook, Stony Brook, NY 11794
.....
Das Kapitel "Gegenwärtige diagnostische Techniken" beginnt mit der Betonung, daß die Diagnose von Lyme-Borreliose letztendlich eine klinische sein muß. In ihrer Tabelle IV bezeichnet Pat Coyle die Labortests als experimentell [d.h. im Entwicklungsstadium] und nützlich zur Unterstützung der Diagnose. Sie sind sehr willkommen, weil außer dem Erythema chronicum migrans [ECM, Wanderröte] keines der Symptome ausreichend charakteristisch sei, als pathognomischer Marker für eine Borrelia burgdorferi Infektion zu dienen. Labortests verwenden Proben von Körperflüssigkeiten, wie Blut, Liquor und Gelenkflüssigkeit. Darüberhinaus entnimmt man für solche Tests Biopsie-Proben von Haut, dem Herzmuskel und dem Synovium [Gelenkgewebe].
Kulturen
Eine Kultur des Erregers wird als der "Goldstandard" (bester Bezugsstandard) bei der Diagnose einer Infektion angesehen. Unglücklicherweise ist es schwierig, B. burgdorferi in menschlichen Körperflüssigkeiten und Organen zu kultivieren oder anzufärben (mit Ausnahme von Biopsie-Proben des frühen ECM, die in 60 - 86% der Fälle Spirochäten nachweisen (34). Vgl. dagegen eine neuere Studie (35), in der Haut-Kulturen nur in 29% ein positives Ergebnis erbrachten).
Beispiele für andere Kulturen von menschlichen Proben: Stony Brook erreichte es in den Jahren 1994 - 1997, 6 kultur-positive Proben vom Liquor zu züchten. Alle 6 Fälle hatten Lyme-Hinrhausentzündung, eine frühe Erscheining einer im Körper ausgebreiteten neurologischen Erkrankung. Das Kultur-Protkoll: 0.5 Kubikzentimetern Liquor wurden in 4.5 Kubikzentimeter BSK-H Medium (der Firma Sigma Chemical Co., St Louis, MO) eingebracht und dann bei 33 C bis zu 12 Wochen gehalten. Der Liquor wurde alle paar Wochen mit Dunkelfeld-Mikroskopie auf Spirochäten untersucht. Spirochäten brauchten typischerweise wenigstens 6 Wochen, bis sie in feststellbaren Mengen im Liquor vorlagen. Der Nachweis, daß es sich um B. burgdorferi handelte, wurde mit PCR erbracht. Interessanterweise zeigte sich eine geringe Heterogenität der DNA/RNA, sodaß vermutet wird, daß ins Nervensystem nur spezielle Stämme eindringen.
Serologie
Der Nachweis von Antikörpern gegen B. burgdorferi ist gegenwärtig der gewöhnlich angewendete Labortest, obwohl -wie die Aufstellung in Tabelle V zeigt- unglücklicherweise eine Reihe von Problemen dabei bestehen. Es treten falsch-positive und falsch-negative Ergebnisse auf. Die Tabelle V gibt als Grund für falsch-positive Resultate
und für falsch-negative Resultate
- ein zu frühes Stadium der Infektion (zu Anfang der Infektion sind
alle Patienten seronegativ).
-
frühzeitige Antibiotika-Einnahme, welche die humorale Immunantwort abschwächt, im Sinne daß sich meßbare Konzentrationen von freien Antikörpern nicht entwickeln. Beispiele sind Amoxicillin, Azithromycin, Doxycyclin.
-
Test-Variabilität.
Die Variationsbreite ist verursacht durch fehlende [weil nicht bekannte]
Standards bei der
-
der Wahl der Antigene und Reagenzien,
-
der Durchführung,
-
der Interpretation der Meßwerte und
-
der Verwendung von Kontroll-Proben.
Manche Labors erbrachten nur geringe Verläßlichkeit sowohl bei
identischen als auch bei unterschiedlichen Proben (36,
37,
38,
39).
Ein Teil (aber gewiß nicht alle) der seronegativen Patienten haben meßbare anti-B. burgdorferi Antikörper im Blutkreislauf, die in Immunkomplexen gebunden sind [die vor einer Auftrennung der Komplexe in der konventionellen Serologie nicht registriert werden] (40,
41).
Die ganz überwiegend benutzte serologische Untersuchungsmethoden, ELISA (enzyme linked immuno assay) hat die IFA's (indirect immunofluorescenct assays) weitgehend ersetzt. Gegenwärtig verwenden ELISA's
- ganze Zellen, also Spirochäten, die in Gewebekulturen gezüchtet und anschließend gewaschen und mit Ultraschall behandelt wurden wurden, oder
-
gereinigte Protein-Auszüge von diesen ganzen Zellen.
Die Bewertung der gemessenen Konzentration als positiv oder negativ für B. burgdorferi trifft man im Vergleich zu einer negativen Kontroll-Probe, also z.B. nennt man ein Testergebnis positiv, wenn seine optische Dichte 3 Standard-Abweichungen über der mittleren optischen Dichte der Kontrollprobe liegt. Die Empfindlichkeit kann man auf diese Weise auf vernünftige Werte bringen, hat aber aus den angegebenen Gründen ein Problem dabei, den Nachweis ausreichend spezifisch zu führen, d.h. allein B. burgdorferi aufzuzeigen.
Der Western-Immunoblot (WB) gestattet es, die spezifische Aktivität von Antikörpern zu untersuchen. Aguero-Rosenfeld (42) zeigte, daß die Anzahl der Banden auf einem IgM oder IgG Western Blot einen Bezug zur Dauer der Lyme-Borreliose hat und zu ihrer Ausbreitung im Körper (im Sinne des Verlassens des Stadiums des ECM).
Die Kriterien für einen positiven IgM oder IgG Western Blot, welche das Center for Disease Control und die Association of State and Territorial Public Health Laboratory Directors (ASTPHLD) empfohlen haben, könnten sich als zu restriktiv herausstellen. Es gibt Fälle, bei denen die B. burgdorferi Kultur positiv ausfiel und die nach diesen Kriterien niemals Western Blot positiv waren.
Diese Kriterien
-
lassen den Western Blot nur bei positivem oder Grenzwert-ELISA zu, führen einen WB für IgG und IgM bei einer Krankheitsdauer von weniger als 1 Monat, und einen WB für allein IgG nur bei einer Dauer von mehr als einem Monat.
-
bewerten einen IgM WB als positiv, wenn 2 der folgenden 3 Banden erscheinen: P21-24, P39, P41
-
bewerten einen IgG WB als positiv, wenn 5 der folgenden 10 Banden auftreten: P18, P21, P28, P30, P39, P41, P45, P58, P66, P93.
Intrakompartment-Antikörper-Synthese. In der Natur der Antikörper-Tests liegt es, daß sie nur eine Aussage macht darüber, daß der Körper die Antigene wahrgenommen hat, nicht aber darüber, daß eine aktive Infektion vorliegt. Demgegenüber ist eine B. burgdorferi-spezifische Antikörper-Erzeugung im Kompartment der Gelenke oder der Rückenmarkshaut (die sog. intrathekale Antikörper-Produktion) ein indirekter Labornachweis für eine aktive Infektion. Wenn man die Produktion im Blut-Kompartment dagegenhält, sieht man in diesem Fall, daß Antikörper vorzugsweise im Liquor oder in der Gelenkflüssigkeit erzeugt werden, und das beweist bis auf geringe Ausnahmen bei unbehandeltem Patient eine B. burgdorferi-Infektion des Zentralnervensystems oder der Gelenke.
[
Dies ist -entsprechend der obigen Charakterisierung der Antikörper-Tests- ein hinreichender Beweis, aber kein notwendiger, d.h. wir können eine aktive Neuroborreliose haben, auch ohne Antikörper in unserem Liquor zu erzeugen - eben dann, wenn unser Körper die Antigene nicht wahrgenommen hat.
Literatur
- Fallon BA, Goldhagen H, Neurologic Lyme Disease: Defining and Treating an Elusive Target, An In-depth Study of Neurocognitive and Behavioral Lyme Disease, 14th International Scientific Conference on Lyme Disease & Other Tick-Borne Disorders, 2001 (in chache)
- Tugwell P, Dennis DT, Weinstein A, Wells G, Shea B, Nichol G, Hayward R, Lightfoot R, Baker P, and Steere AC, Laboratory Evaluation in the Diagnosis of Lyme Disease, Ann Int Med vol 127:1109-1123, 1997 (mit dem Browser nach "intrathecal antibody production" suchen)
- Blanc F, Jaulhac B, Fleury M et al., Relevance of the antibody index to diagnose Lyme neuroborreliosis among seropositive patients. Neurology. 2007 Sep 4;69(10):953-8
Results:
30 of the 40 patients with neuroborreliosis had a positive AI [Liquor/Serum Verhältnis > 1] (AI sensitivity = 30/40 x 100% = 75%).
2 of the 74 patients with another neurologic diagnosis had a positive AI [Liquor/Serum Verhältnis > 1](AI specificity = 72/74 x 100% = 97%).
Conclusions:
The antibody index has a very good specificity but only moderate sensitivity. Given the lack of consensual criteria for neuroborreliosis and the absence of a "gold standard" diagnostic test, we propose pragmatic diagnostic criteria for neuroborreliosis, namely the presence of 4 of the following 5 items:
- no past history of neuroborreliosis,
- positive CSF ELISA serology,
- positive anti-Borrelia antibody index,
- favorable outcome after specific antibiotic treatment, and
- no differential diagnosis.
These new criteria will need to be tested in a larger, prospective cohort.
- J. Gruber, Schwerwiegende Defizite in der Leitlinie Neurologie der deutschen Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften, Zusammenstellung von Material von Brian A. Fallon, Harry Goldhagen und Patricia K. Coyle.
]
In ihrer im Mosby Year Book veröffentlichten Arbeit (44) geht Dr. Coyle auf Einzelheiten ein, wie sie diese Intrakompartment-Antikörper-Synthese, auf Englisch
-
intracompartmental antibody synthesis,
-
oder z.B. bei Synthese im Liquor: intrathecal compartmentalized organism-specific antibody production;
-
und ähnlich für Gelenkflüssigkeit: intrasynovial compartmentalized organism-specific antibody production.
nachweist. Eine Methode besteht darin, zwei (normierte) ELISA-Ergebnisse
zu vergleichen:
-
das eine ist mit Liquor (oder Gelenkflüssigkeit) bestimmt worden,
-
das andere mit Serum.
Jedes dieser beiden Ergebnisse ist normiert in dem Sinne, daß es eine Verhältniszahl ist aus dem ELISA-Wert für IgG im Zähler und dem Wert für alle Immunglobuline zusammengenommen (die totale Immunglobulin-Konzentration darstellend) im Nenner. In mathematischer Form für Liquor geschrieben:
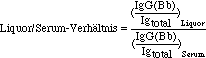
wobei
IgG(Bb) = B.burgdorferi-spezifische Immunglobulin G-Konzentration,
Igtotal = gesamte Immunglobulin-Konzentration,
(...)Liquor = Wert der Klammer im Liquor,
(...)Serum = Wert der Klammer im Serum.
Polymerase Kettenreaktion (Polymerase Chain Reaction, PCR)
Die PCR wird benutzt, um B. burgdorferi DNA/RNA in einer Reihe von Proben zu bestimmen, angefangen von Körperflüssigkeiten (Serum, Liquor, Gelenkflüssigkeit, Urin, Gesamtblut und Plasma , wie in den Veröffentlichungen (45, 46, 47, 48) dargestellt) bis hin zu Gewebeproben. Je nach Labor und Wissenschaftler gibt es positive Ergebnisse bei einem großen oder kleineren Bruchteil der Borreliosefälle. Positive Ergebnisse findet man
[Abnormalitäten im Liquor sind mehr üblich bei früher als bei später Borreliose. Sie könnten sich dann in einer erhöhten Konzentration (Pleocytose) der mononukleären Zellen (Monozyten, Leukozyten) äußern, einem erhöhtem Proteingehalt und möglicherweise in der erwähnten intrathekalen Antikörperproduktion. PCR-Nachweise im Liquor sind notorisch schlecht. Selbst bei einer stark ausgeprägten Borreliose-Hirnhautentzündung ergeben weniger als die Hälfte der Proben ein positives PCR-Ergebnis. J. Gruber]
Die Qualität der Primer bestimmt das Ergebnis. Es wurden Primer zum Nachweis von
- chromosomal kodierten Proteinen (flagellin, 16 S ribosomale
RNA) und
- Plasmid-kodierten Proteinen (OspA, OspB) benutzt. Letztere scheinen eine höhere Ausbeute bei klinischen Proben zu ergeben (49).
Vorteil der Methode::
-
Die Auflösung kann sehr hoch sein: eine Spirochäte in einer klinischen Probe.
-
PCR-nachgewiesene DNA bedeutet nicht, daß lebende Organismen vorliegen.
Aber Malawista und Mitarbeiter (50) vermuten, daß
PCR-positive Ergebnisse nach wirksamer Antibiotika-Behandlung verschwinden.
Nachteil der Methode:
-
Fehlende Standardisierung für Routine-Untersuchungen.
-
Protokolle und Primer sind noch nicht auf Empfindlichkeit und Spezifität optimiert, z.B. mit Liquor liegt die Empfindlichkeit auf B. burgdorferi weit unter 100%.
-
Geringste Verunreinigung im Labor können falsch-positive Resultate
erzeugen.
Im Kapitel Techniken in der Entwicklung bewertet Dr. Coyle eine
neue in der Forschung befindliche Generation von Tests. Man versucht, die
serologischen Tests durch die Auswahl der Primer-Antigene zu verbessern
(51, 52).
-
Dabei sind für die (indirekte) ELISA rekombinante Proteine OspA - C versucht worden. Ergebnisse bei chronischer Neuroborreliose sind schlechter als mit traditioneller Ganz-Zellen-ELISA, im ECM oder frühen generalisierten Stadium sind die Tests mit rekombinantem OspC denen mit traditionellen Ganz-Zellen überlegen (53, 54, 55).
-
B. burgdorferi gibt Teile seiner äußeren Membran [zusammen mit
den Lipoproteinen Osp und DNA] an seine Umgebung ab (diese Teile werden
als Blebs [oder Zysten] bezeichnet (56, 57,
58,
59,
60,
61)).
Eine Reihe von experimentellen (nicht für allgemeinen Gebrauch standardisierten)
Tests weisen solche Antigene in Menschen und Tieren nach (62,
63,
64,
65).
[Dazu gehört der Lyme Urine Antigen Test von IGeneX (68)]. Das Forschungslabor der Neurologie in Stony Brook hat einen ELISA für OspA in Liquor mit guten Resultaten verwendet (66, 67):
-
Empfindlichkeit: 100% Radikuloneuritis, 60% Hirnhautentzündung, andere Lyme-Erscheinungen unter 47%.
-
Spezifität: 99.3%.
-
Nachweisgrenze: 0.03 nanogram pro Probe.
-
Bestätigung:
- durch Kultur in 6 von 6 Fällen,
- durch PCR in 7 von
7 Fällen,
Zusammenfassung
Es gibt zwei noch ungelöste diagnostische Aufgaben bei der Lyme-Borreliose:
-
die Bestimmung einer aktiven Infektion und
-
eine verläßliche weithin anwendbare Antikörper-Bestimmungsmethode
(screening assay).
Für den ersten Problemkreis werden standardisierte Techniken entwickelt
-
zur PCR-Analyse (Bestimmung von B. burgdorferi DNA),
-
zur Antigen-Analyse (Bestimmung von B. burgdorferi Proteinen)
-
zur Feststellung einer Infektion in isolierten Körper-Kompartments [isoliert im Sinne von "vom Immunsystem losgelöst, ihm schwer zugänglich']. Hier braucht man verbesserte Antikörper-Bestimungen .
Im zweiten Problembereich des empfindlichen und spezifischen Antikörper-Nachweises sucht man nach verbesserten Antigen-Quellen für ELISA und WB. Dies wären rekombinant herstellbare B. burgdorferi Proteine, die für das Immungeschehen verantwortlich sind. Literaturhinweise
34. Berger BW, Johnson RC, Kodner C, Coleman L, J Clin Microbiol 1992;30:359-361.
35. Wormser GP, Forseter G, Cooper D et al.,
JAMA 1992;268:1311-1313.
36. Corpuz M, Forseter G, Cooper D et al. JAMA
1991; 268:1211-1313.
37. Hedberg CW, Osterholm MT, MacDonald KL et al.
J. Infect Dis 1987; 155:1325-1327.
38. Luger SW, Krauss E, Arch Intern Med 1990;150:761-763.
39. Schwartz BS, Goldstein MD, Ribeiro JMC et al.
JAMA 1989;262:3431-3434.
40. Schutzer
SE, Coyle PK, Belman AL et al. Lancet 1990;1:312-315.
41. Schutzer
SE, Coyle PK, Dunn JJ, Luft BJ, Brunner M J Clin Invest Jul;1994(1):454-457,
1994.
42. Aguero-Rosenfeld ME, Nowakowski J, Bittger S
et al., J Clin Microbiol 1996;34:1-9.
43 Centers for Disease Control, MMWR 1995; 44:590-591.
44. Coyle PK in Lyme Disease, Mosby Year Book,
St. Louis 1993:136-148.
45. Bradley JF, Johnson RC, Goodman JL, Ann
Intern Med 1994;120:487-489.
46. Karch H, Huppertz HI, Bohme M et al., J
Clin Microbiol 1994;32:2312-2314.
47. Luft BJ, Steinman CR, Neimark HC et al.,
1992;267:1364-1367.
48. Moter SE, Hofmann H, Wallich R et al., J
Clin Microbiol 1994;32:2980-2988.
49. Persing DH, Rutledge BJ, Rys PN et al.,
J Infect Dis 1994;169:668-672.
50. Malawista SE, Barthold SW, Persing DH, J.
Infect Dis 1994;170:1312-1316.
51. Magnarelli LA, Fikrig E, Padula SJ et al.,
J Clin Microbiol 1996;34:237-240.
52. Rauer S, Kayser M, Neubert U et al., J Clin
Microbiol 1995;33:2596-2600.
53. Fung BP, McHugh GL, Leong JM, Steere AC,
Infect Immun 1994;62:3213- 3221.
54. Gerber MA, Shapiro ED, Bell GL et al., J
Infect Dis 1995;171:724-727.
55. Padula SJ, Dias F, Sampiere A et al., J
Clin Microbiol 1994;32:1733-1738.
56. Barbour AG, Hayes SF, Microbiol Rev 1986;50:381-400.
57. Brade V, Kleber I, Acker G, Immunobiol 1992;185:453-465.
58. Dorward DW, Schwan TG Garon CF, J Clin Microbiol
1991;289:1162-1170.
59. Garon CF, Dorward DW, Corwin MD, Scanning
Microsc Suppl 1989;3:109 115.
60. Katona LI, Beck G Habicht GS, Infect Immun
1992;60:4995-5003.
61. Whitmire WM, Garon CF, Infect Immun 1993;61:1460-1467.
62. Benach JL, Coleman JL, Golightly MG, J Immunol
1988;140:265-272.
63. Dorward DW, Schwan TG, Garon CF, J Clin
Microbiol 1991;29:1162-1170.
64. Garcia-Monco JC, Villar BF, Alen JC, Benach
JL, J Infect Dis 1990;161:1187-1193.
65. Hyde FW, Johnson RC, White TJ, Shelburne CE,
J Clin Microbiol 1989;27:58-61.
66. Coyle PK, Deng Z, Schutzer SE et al., Neurol
1993;43:1093-1097.
67. Coyle PK, Schutzer SE, Deng Z et al., Neurol
1995;45:2010-2015.
[68. Barkley M., Harris N, Szantyr B, 10th Annual
Int. Conf. On Lyme Borreliosis, National Institue Of Health, Bethesda,
Md. April 28-30, 1997.]
J Clin Microbiol 1997 Mar;35(3):537-43
Vergleich der Test-Resultate zur Feststellung von Lyme-Borreliose in 516 Laboratorien (Teilnehmern am Wisconsin State Laboratory of Hygiene/College of American Pathologists Proficiency Testing Program.)
-Interlaboratory comparison of test results for detection of Lyme disease by 516 participants in the Wisconsin State Laboratory of Hygiene/College of American Pathologists Proficiency Testing Program.
Bakken LL, Callister SM, Wand PJ, Schell RF
Department of Continuing and Vocational Education, University of Wisconsin,
Madison 53706, USA.
Im Jahr 1991 berichteten wir, daß 55 % der Labors, der am Wisconsisn
Qualitätstest Program teilnahmen, Serum-Proben von Lyme-Borreliose-Kranken
mit Antikörpern gegen Borrelia burgdorferi (dem Borreliose-Bakterium,
D. Übers.) nicht richtig identifizieren konnten.
Die Absicht der jetzt vorgelegten Studie war es, zu bestimmen, ob die
Genauigkeit der Lyme-Borreliose-Testergebnisse sich verbessert hat, die von etwa 500 Teilnehmern an der Lyme-Borreliose-Übersichtstudie des Landeshygieneinstituts/Kollegium der Amerikanischen Pathologen abgegeben wurden.
Von 1992 bis 1994 wurden 50 Serum-Proben den Teilnehmern an der Studie zugesandt. Jedes Labor erhielt 28 Serum-Proben von Menschen mit Lyme entsprechend der Definition des Zentrums für Krankheitsbekämpfung und -vorbeugung (Center for Disease Control and Prevention, CDC) und 22 Serum-Proben von gesunden Menschen.
Unglücklicherweise hat sich die Serodiagnostik der Lyme-Borreliose
der Teilnehmer nicht verbessert.
-
Die Spezifität der Lyme-Untersuchungen nahm während des 3-Jahreszeitraums der Studie stetig von etwa 95% auf etwa 81% ab. (Spezifität = Vermögen zwischen Lyme und anderen Krankheiten zu unterscheiden, d. Übers.)
-
Falsch-positive Testergebnisse erreichten einen Bruchteil von 55% bei einigen Proben von gesunden Probenspendern.
-
Eine Serum-Probe mit Antikörpern gegen Treponema pallidum wurde als Lyme-posisitiv von 70% der Teilnehmer eingestuft. (T. pallidum ist der Erreger von Syphilis, er gehört zur gleichen Bakteriengattung (Spirochaeta) wie Borrelia burgdorferi, d. Übers.).
-
Darüberhinaus schwankte die Empfindlichkeit (des Tests) zwischen 93
und 75%, in Abhängigkeit vom Konjugat, das die Labors benutzten (K.
= Hilfsmittel zur Erkennung der Antikörper, d. Übers.).
Diese Ergebnisse legen nahe, daß bindendere Kriterien angewendet werden müssen bei der Zulassung und deren Verlängerung von kommerziell verfügbaren Test-Zubereitungen für die Serodiagnostik von Lyme-Borreliose.
VIII. International Potsdam Symposium, 23. February, 2005
U. Everth, U. Weller, A. Waldherr
Laborzentrum Berlin, Landgrafenstr. 16, D - 10787 Berlin, Germany, Telephone: +49 30 301 188-28
ABSTRACT
Lyme-Borreliosis is gaining in importance as an emerging disease. Estimates of incidences for central Europe
reach 237 per 100.000 per year and in some regions are as high as 1.5% per year. The spectrum of symptoms is complex and clinical diagnosis in the case of multiple "general symptoms" is difficult and in many cases not reliable.
Antibody-based diagnosis is often not able to solve diagnostic problems either, due to "false-positive" and "false-negative" results.
- The serologic result gives a limited answer concerning the stage of Lyme-Borreliosis.
- However, the serologic result gives a clue to whether an infection with Borrelia burgdorferi sensu lato has occurred in the past.
- It is of limited value for proving success of therapy.
Generally a two-step serodiagnosis - similar to HIV-diagnostics - is used:
- If the result of the screening-assay (ELISA, i-IFT, HAT or KBR) points towards the presence of antibody
- it is confirmed by Western-/ Immuno- Blot.
The diagnosis is established by the presence of certain bands.
It is shown that the
diagnostic value of test-kits from different manufacturers may differ considerably. This may even result in missing the diagnosis (Lyme) in certain cases- if a non-appropriate system is used.
This poster demonstrates possible influences on serologic diagnostics. Examples are given by blot-stripes from the daily routine.
Journal of Clinical Microbiology, Aug 1993, p.
1961-1963
LYME BORRELIOSE: Die vernünftige Suche nach Antworten
Lyme Borreliosis: The sensible pursuit of answers
Kenneth B. Liegner, M.D., P.C.
.....
Viele Ärzte und Wissenschaftler räumen ein, daß es seronegative
Lyme-Borreliose gibt, behaupten aber, daß es sich um ein seltenes
Phänomen handelt. Tatsächlich wurden in Forschungszentren bei
Studien seronegative Patienten, deren Symptome mit denen von Lyme-Borreliose übereinstimmen, ausdrücklich ausgeschlossen. Es ist möglich, daß dies ein schwerer konzeptioneller und methodologischer Fehler ist. Das gegenwärtige Verständnis der menschlichen Immunreaktion auf B. burgdorferi ist rudimentär.
-
Die Antikörperreaktion, so stark und unveränderlich sie bei manchen
Patienten ist, kann mit der Zeit wachsen oder schwinden.
-
Diagnostische serologische Titer sind bei wieder anderen Patienten vielleicht
nicht nachweisbar - aus Gründen, die gegenwärtig nur wenig verstanden
werden.
-
Mindestens vier Gruppen von Wissenschaftlern halten es für möglich,
daß Immunkomplexe in Serum und/oder Liquor vorhanden sind (3,
5,
10,
32):
Bei Patienten mit Antigenüberschuß können Antikörper nicht nachweisbar sein und erst dann entdeckt werden, wenn solche Immunkomplexe aufgebrochen werden. Somit sind gerade Patienten, die nicht in der Lage sind, ein meßbares Niveau an freien Antikörpern zu erzeugen, also am wenigsten die Infektion einzudämmen vermögen und somit schwerer erkranken, auch ausgerechnet die, die keine Behandlung erhalten.
-
Zum Beispiel war die oben beschriebene Patientin in den ersten fünf Jahren ihrer Erkrankung seronegativ, entwickelte aber während dieser Zeit schwere und irreversible neurologische Schäden. Ihre Western-Blot-Testergebnisse waren nicht eindeutig, als B. burgdorferi von ihrem Liquor isoliert wurde. Dieses Beispiel unterstreicht, daß es ein Trugschluß ist zu glauben, der Western-Blot sei der "Gold-Standard"-Test für eine eindeutige Lyme Diagnose
-
Der Antigen-Capture-Assay, entwickelt vom Rocky Mountain Laboratory des
National Institute for Allergy and Infectious Disease (NIAID, 6) macht abgespaltene, für B. burgdorferi spezifische Antigene im Urin von vielen Patienten sichtbar, bei denen zwar der Verdacht auf Lyme-Borreliose bestand, die aber seronegativ waren (21).
Die Verfügbarkeit von direkten Antigenuntersuchungen, die Polymerase-Kettenreaktion (polymerase chain reaction, PCR) und andere Ansätze zum direkten Nachweis des Erregers werden, wenn sie klinisch bestätig sind, zu einer rationaleren pharmakologischen Therapie der Lyme-Borreliose führen. Die Ergebnisse dieser Untersuchungen werden helfen zu erkennen, was pragmatische Ärzte seit langem durch das sorgfältige Studium ihrer Patienten erkannt haben: daß Seronegativität ein tatsächliches Phänomen bei Lyme-Borreliose ist, das sowohl im Früh- als auch im Spätstadium der Erkrankung auftritt (4, 21).
Wenn seronegative Lyme-Borreliose anerkannt wird, macht das eine empirische Behandlung von Patienten, bei denen der klinische Verdacht auf Lyme-Borreliose besteht, zwingend notwendig.
Literaturhinweise
3. Coyle PK, Belman AL, Krupp LB, B. burgdorferi-specific immune complexes in cerebrospinal fluid, abstr. 167, p. A29. Program Abstr. 5th Conf. Lyme Borreliosis. 1992.
4. Coyle PK. Schutzer SE, Belman AL, Krupp LB, Deng Z, Cerebrospinal fluid immunologic parameters in neurologic Lyme disease, p. 31-43. In S. E. Schutzer (ed), Lyme disease molecular and immunologic approaches. Current communications in cell and molecular biology . Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.1992
5. Dorward DW, Huhuenel ED, Davis G, Garon CF, Extracellular Borrelia burgdorferi proteins interact with non-borrelia-directed IgM antibodies. abstr. 219, p. A38. Program Abstr. 5th Int. Conf. Lyme Borreliosis, 1992.
10.Hardin JA, Steere AC, Malawista SE, Immune complexes and the evolution of Lyme arthritis. Dissemination and localization of abnormal C1q binding activity. N. Engl. J. Med 1979;301:1358-1363.
21. Liegner KB, Dorward DW, Garon CF. Lyme borreliosis (LB) studied with the Rocky Mountain Laboratory (RML) antigen-capture assay in urine. abstr. 104, p. A18. Program Abstr. 5th Int. Conf. Lyme Borreliosis, 1992.
32. Schutzer SE, Coyle PK, Brunner M, Specific serum immune complexes in Lyme disease. abstr. 135, p. A24. Program Abstr. 5th Int. Conf. Lyme Borreliosis, 1992.
International Lyme and Associated Diseases Society
Epidemiol Mikrobiol Imunol. 2001 Nov;50(4):147-56.
[Criteria for evaluation of immunoblots using Borrelia
afzelii, Borrelia garinii and Borrelia burgdorferi sensu stricto for diagnosis
of Lyme borreliosis]
[Article in Czech]
Honegr K, Havlasova J, Gebousky P, Dostal V, Pellantova V, Skrabkova Z, Hulinska D.
Infekcni klinika FN, Hradec Kralove.
The immunoblot was prepared from genotypes Borrelia afzelii (KC 90),
Borrelia garinii (M 192) and Borrelia burgdorferi sensu stricto (B 31).
Sera of
-
63 patients with different forms of Lyme borreliosis were examined and
-
40 healthy donors in the endemic area of the disease.
In class IgM in the group of patients significantly more frequently antibodies
against
-
OspC,
-
p39,
-
p41 B. afzelii,
-
p39,
-
p41,
-
p66,
-
p83 B. garinii and
-
OspC1, OspA, B. burgdorferi sensu stricto
were found.
In class IgG there were antibodies against
-
p39,
-
p41,
-
p93 B. afzelii,
-
p14,
-
p41,
-
p93 B. garinii and
-
OspA, OspC p93 B. burgdorferi sensu lato.
Based on the assembled results by means of discrimination analysis and
logistic regression
-
the most suitable combinations of antigens for evaluation of immunoblots
in different genotypes were determined.
-
Furthermore evaluation was suggested using a combination of antigens of
several genotypes which led to an increased sensitivity and specificity
of the immunoblot.
-
Tables were prepared for easier evaluation of newly examined sera samples.
PMID: 11769176 [PubMed - indexed for MEDLINE]
In a significant scientific breakthrough, scientists recently discovered
6 surface proteins on Borrelia burgdorferi that remain constant (i.e. do
not change due to "antigenic variation" like the Outer surface proteins,
OspA, ... OspC). Scientists call these "invariable regions" (IR), which
are termed IR1-6. One IR, IR6 is found in all strains of the Lyme disease
pathogen and induces a strong immune response in infected patients. The C6 Lyme Peptide ELISA (C6 LPE) detects antibodies to the IR6 in infected patients (source:
Lyme Disease Foundation).
Siehe auch C6 Lyme Peptide Elisa.
Adresse dieser Seite ist: http://www.lymenet.de/labtests/Labtests.htm
Die home page dieser website ist
http://www.lymenet.de.
Stand: 30. September 2011.
Joachim
Gruber.

